2023年9月,真迈生物合作客户复旦大学附属中山医院孙爱军和葛均波团队在《Redox Biology》(IF: 11.4) 杂志上发表了一篇题为“缺血再灌注模型中内源性腺苷的积累通过表观遗传重编程改善心肌细胞代谢”的科研文章。该文章探讨了心脏细胞中腺苷激酶(ADK)在心肌缺血再灌注(I/R)损伤中的作用,并探索了其作为治疗靶点的潜力。研究发现,通过抑制ADK,可以导致心肌细胞内腺苷积累,降低DNA甲基转移酶1(DNMT1)的表达,并引起基因组的低甲基化。此外,ADK敲除还增加了胰岛素样生长因子-1(IGF-1)的转录,促进心肌细胞的葡萄糖代谢。这些变化共同作用可以减轻心肌缺血再灌注损伤,该研究提供了一种新的治疗策略。
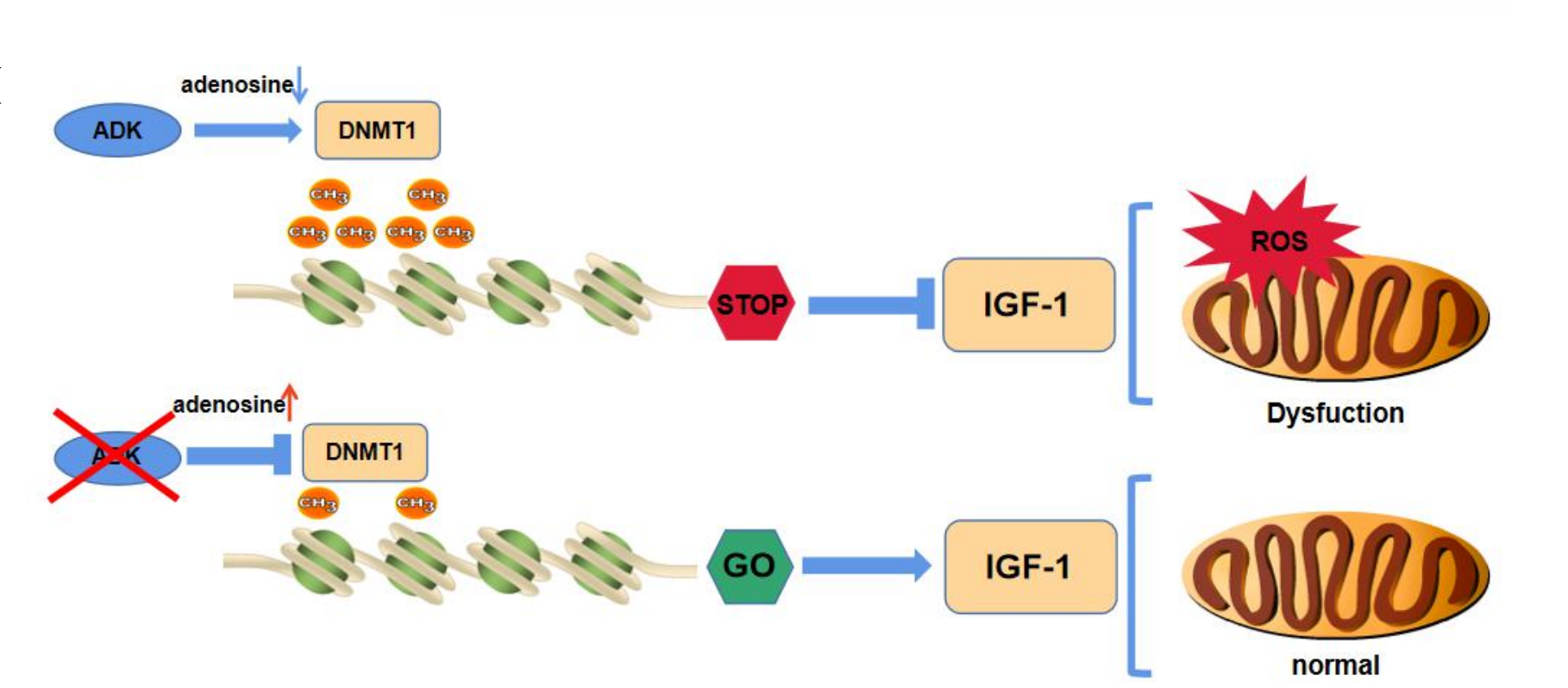
图1 心肌ADK/DNMT1/IGF-1轴的机制模型及其下游代谢作用
心脏缺血再灌注(I/R)损伤会引起缺血性心脏病的长期不良预后,且与缺血性心脏病的高发病率相关。因此,寻找减轻再灌注损伤的新靶点是临床治疗中亟需解决的问题。腺苷激酶(ADK)在心脏腺苷代谢中起着重要作用,而抑制ADK会增加心肌腺苷水平。尽管已有研究证实细胞外腺苷对缺血/再灌注(I/R)的心脏有保护作用,但是ADK在心脏I/R损伤中的作用机制目前尚不清楚。
研究者构建了不同时间点的I/R小鼠模型,使用真迈生物GenoLab M测序仪对I/R组和对照组样本进行了转录组测序。结果表明:相对对照组,ADK基因的表达在I/R组显著上调。通过与ADK相关通路分析发现,在I/R组中,ADK、DNMT1(DNA甲基化转移酶1的编码基因,负责在细胞分裂过程中维持DNA甲基化水平)和其他代谢相关基因发生了显著变化(图2C)。此外,相关性分析显示,ADK与IGF-1(胰岛素样生长因子1的编码基因,对细胞生长、增殖和存活起重要作用)呈强负相关,与DNA甲基化相关编码基因呈中等负相关(图2D)。
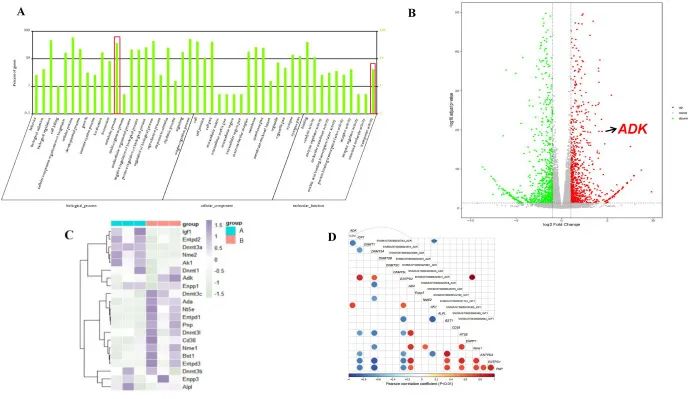
图2 ADK被发现是参与I/R期间代谢变化的潜在候选基因
此外研究发现,敲除心肌细胞中ADK基因可以导致细胞内腺苷积累,降低DNA甲基转移酶1(DNMT1)的表达,并导致DNA低甲基化状态。这些变化与改善心肌细胞的葡萄糖代谢和减轻心肌I/R损伤有关。ADK的缺失通过调节DNMT1和胰岛素样生长因子-1(IGF-1)的表达,发挥心脏保护作用。IGF-1的表达增加可以逆转ADK缺失对心肌I/R损伤的保护效应,表明增加IGF-1表达可能具有治疗心肌I/R损伤的潜力。最后通过动物模型和细胞实验,研究人员进一步探索了ADK缺失对心肌能量代谢的影响,并发现ADK/DNMT1/IGF-1轴在调节心肌细胞能量代谢中起着重要作用。
总的来说,该研究揭示了心肌细胞中ADK的缺失对心肌I/R损伤的保护作用,以及ADK/DNMT1/IGF-1轴在调节心肌能量代谢和心脏保护中的重要性。
本研究通过转录组测序发现ADK基因在I/R组中高表达,随后探究了ADK在心肌I/R损伤中的作用及其对葡萄糖代谢的影响。研究表明,ADK缺失诱导的腺苷积累和随后DNMT1和IGF-1表达的调节有助于观察到的心脏保护作用。这些发现有助于我们理解心脏健康和患病状态下代谢与表观遗传修饰之间复杂的相互作用。
Wang P, Gao R, Wu T, et al. Accumulation of endogenous adenosine improves cardiomyocyte metabolism via epigenetic reprogramming in an ischemia-reperfusion model[J]. Redox Biology, 2023, 67: 102884.