近日,真迈生物用户俄罗斯科学院托木斯克国立研究医学中心癌症研究所在Scientific Reports上发表了题为“Revealing molecular mechanisms of early-onset tongue cancer by spatial transcriptomics”的科研成果。该研究基于真迈生物GenoLab M高通量基因测序平台,分别对9例舌鳞状细胞癌样本进行空间转录组学测序,并对2例样本进行单细胞转录组学测序,全面揭示了早发性舌鳞状细胞癌的独特转录组特征和潜在分子机制,为该癌症的进一步研究和个性化治疗提供了参考。
舌鳞状细胞癌(Tongue Squamous Cell Carcinoma, TSCC)是一种起源于舌黏膜鳞状细胞的恶性肿瘤,是舌恶性肿瘤中最常见的组织病理类型。在年轻人中,早发性TSCC的发病率、侵袭性和对治疗的不良反应均呈现增加趋势,但传统的病因因素如烟草、酒精和人乳头瘤病毒(HPV)似乎并不与之相关。这意味着,我们对这种癌症的了解还存在很大空白,需要进一步探索其致病机制。
肿瘤组织是一个极其复杂的系统,包含肿瘤细胞与微环境各细胞群的相互作用。这种复杂性极大地限制了早发性TSCC的研究。空间转录组学技术能够分析组织内原始位置的单个细胞的转录组,揭示肿瘤核心区域与转移边缘区域的转录组差异,并确定预后相关的基因表达模式,已成为肿瘤学研究的有利工具。单细胞转录组技术允许在单细胞水平直接分析基因表达,提供了比传统组织块测序更高的分辨率,能够揭示细胞亚群的差异。通过这些高通量测序手段,研究人员能够更深入地理解肿瘤的分子异质性,并鉴定潜在的治疗靶点,对早发性TSCC新型治疗策略的制定具有重要意义。
丨早发性TSCC的空间转录组学特征
通过早发性TSCC的空间转录组测序(图1),研究人员共获得9类细胞簇,涵盖了肿瘤细胞、肿瘤相关成纤维细胞、上皮细胞、淋巴细胞以及骨髓免疫细胞等。这些细胞簇各自表达其特征性的分子标记基因,揭示了它们的独特身份和功能。例如,肿瘤细胞中KRT1、KRT4、KRT5、KRT10、KRT13和KRT14等角蛋白基因表达水平较高;而在肿瘤相关成纤维细胞中,COL1A1、VIM和LUM等基因高表达。在早发性TSCC的肿瘤细胞簇中,与氧化应激、血管拟态、MAPK和JAK-STAT信号通路相关的基因表达显著增加,这些信号通路的激活可能与肿瘤进展和微环境调节密切相关。此外,肿瘤微环境的基因表达特征也显示出与骨髓源性抑制细胞、肿瘤相关巨噬细胞和浆细胞相关的基因表达水平上升,反映了肿瘤微环境中免疫抑制和炎症反应的激活。另外,在肿瘤侵袭的前沿区域,伴随着血管拟态现象,肿瘤相关巨噬细胞的排列及浆细胞和淋巴细胞的聚集,共同构成了类似三级淋巴结构的特殊微环境。这种结构的形成可能与肿瘤的免疫逃逸和进展有关,为肿瘤细胞提供了一个支持其生长和转移的有利环境。图1 早发性TSCC的空间转录组特征
丨早发性TSCC的单细胞转录组测序
为进一步验证空间转录组测序的结果,研究人员又进行了TSCC的单细胞转录组测序。结果显示,肿瘤细胞簇中MAPK和JAK-STAT信号通路显著富集,这可能是TSCC发展的关键驱动因素。在免疫微环境中,免疫细胞簇显示出抗原加工和呈递相关基因的表达减少,T细胞受体基因表达的降低,显示了肿瘤微环境中的免疫抑制现象;而与血管拟态相关的基因表达升高,可能促进肿瘤的侵袭和转移。早发性TSCC的单细胞转录组测序结果支持了空间转录组学揭示的基因表达特征,进一步证实了这些特征在TSCC发展中的重要作用,为未来的治疗策略提供了潜在的靶点。
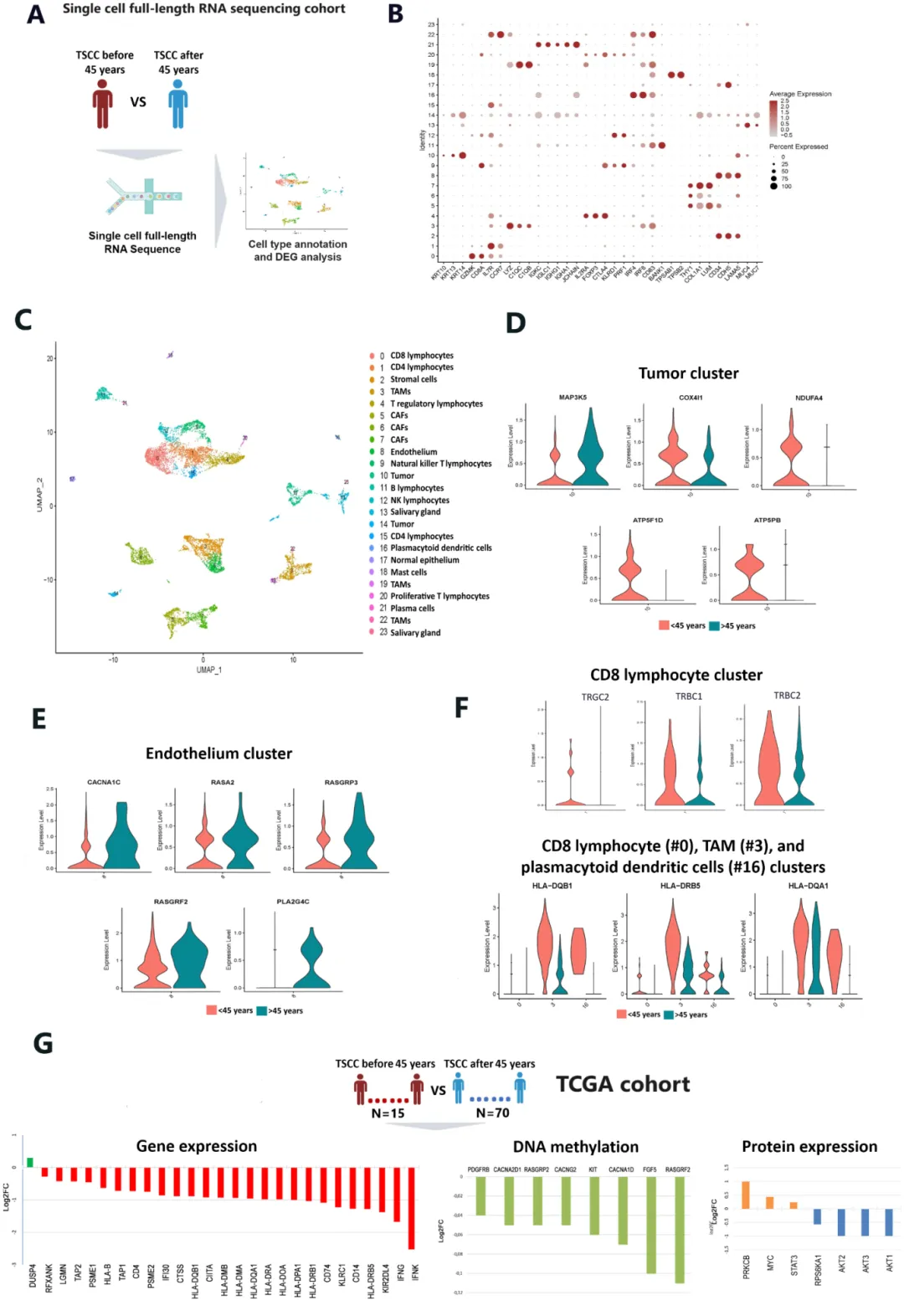
图2 早发性TSCC的单细胞转录组特征
1、空间转录组及单细胞转录组测序揭示了早发性TSCC的独特转录组特征和潜在分子机制;
2、早发性TSCC的肿瘤细胞簇中,MAPK和JAK-STAT信号通路显著富集,而在肿瘤微环境中,存在免疫抑制现象;
3、早发性TSCC的肿瘤侵袭前沿区域,伴随着血管拟态现象以及三级淋巴结构的特殊微环境,可能促进肿瘤细胞的免疫逃逸、侵袭与转移。
Patysheva, Marina R., et al. "Revealing molecular mechanisms of early-onset tongue cancer by spatial transcriptomics." Scientific Reports 14.1 (2024): 26255.